AG Enz
Professur für Biochemie und Medizinische Molekularbiologie
Leitung:
Prof. Dr. Ralf Enz
Institut für Biochemie
Professur für Biochemie und Medizinische Molekularbiologie (Prof. Dr. Enz)
- Telefon: +49 9131 85-24185
- E-Mail: ralf.enz@fau.de
Forschungsschwerpunkt
Das zentrale Nervensystem besteht aus über 100 Milliarden Nervenzellen, die unter sich eine Vielzahl von Kontakten (Synapsen) ausbilden, und ist damit das komplexeste Organ des Menschen. Die Aktivität dieses neuronalen Netzwerkes wird durch ein koordiniertes Zusammenspiel erregender und inhibierender Neurone generiert. Auf molekularer Ebene wird die Balance zwischen Erregung und Inhibierung durch ein räumlich und zeitlich geordnetes Zusammenspiel synaptischer Proteine kontrolliert. Bei diesem Prozeß ist vor allem eine korrekte Anzahl von Ionenkanälen und Neurotransmitterrezeptoren, sowie deren Regulation durch Kinasen, Phosphatasen und weiterer Enzyme von grundlegender Bedeutung. Ankerproteine fixieren die Kanäle und Rezeptoren am synaptischen Cytoskelett und Adapterproteine stellen eine räumliche Nähe zwischen funktionell zusammenwirkenden Proteinen sicher. Auf diese Weise bilden sich synaptische Signalkomplexe, die Menge, Lokalisierung und Aktivität von Ionenkanälen und Neurotransmitterrezeptoren kontrollieren und damit Qualität und Stärke der synaptischen Signalübertragung regulieren.
Synaptische Signalkomplexe sind dynamische Strukturen, die in Abhängigkeit des physiologischen Zustandes eines Neurons assemblieren bzw. dissoziieren. Störungen in Aufbau und Regulation dieser Proteinkomplexe kann zu neuronalen Fehlfunktionen und pathophysiologischen Prozessen, wie z.Bsp. Nachtblindheit, Epilepsie, Schizophrenie, Parkinson, Formen von Autismus und chronischen Glaukomerkrankungen führen. Somit repräsentieren synaptische Signalkomplexe interessante Zielstrukturen für neue Therapieansätze.
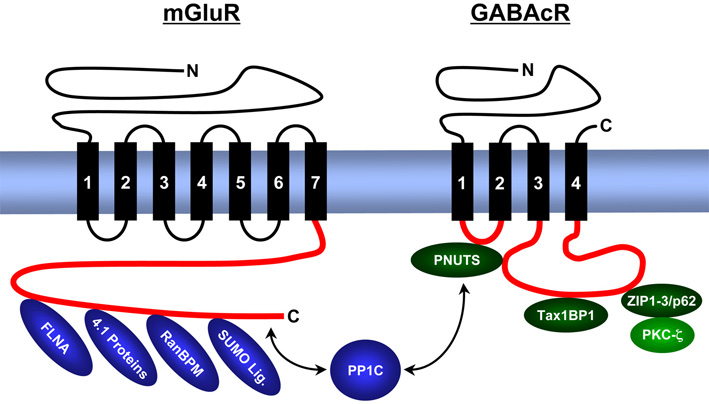
Wir untersuchen Aufbau, Expression, Struktur und Funktion synaptisch lokalisierter Signalkomplexe, die mit Rezeptoren für den erregenden Neurotransmitter Glutamat, die inhibierenden Neurotransmitter γ-Aminobuttersäure (GABA) und Glycin, sowie mit weiteren Ionenkanälen (spannungsgesteuerte Chloridkanäle – ClC, epitheliale Natriumkanäle – ENaC) assoziiert sind. Die Abbildung gibt eine Übersicht über von uns identifizierte Proteine, die an intrazelluläre Domänen von metabotropen (G-Protein gekoppelten) Glutamatrezeptoren und GABAc Rezeptoren binden.
Wir lokalisieren interagierende Proteine im zentralen Nervensystem (Netzhaut) durch immunhistochemische Techniken, kartieren an den Bindungen beteiligte Proteindomänen durch eine Kombination molekularbiologischer und proteinchemischer Methoden, und analysieren deren dreidimensionale Struktur durch bioinformatische (computer based homology modelling, molecular dynamics simulations) und biophysikalische Techniken (CD und NMR Spektroskopie).
Als Ergebnis dieser Studien postulieren wir die Existenz trimerer synaptischer Signalkomplexe, bestehend aus GABAc Rezeptoren / PNUTS / PP1C, bzw. aus GABAc Rezeptoren / ZIP Proteinen / PKC-ζ. Die enzymatischen Aktivitäten der Phosphatase und Kinase regulieren den Phosphorylierungsgrad und die Oberflächenexpression der GABAc Rezeptoren. Weitere Signalkomplexe bestehen aus metabotropen Glutamatrezeptoren, PP1C und SUMO Proteinen und regulieren die Oberflächenkonzentration und intrazelluläre Signalkaskaden dieser Neurotransmitterrezeptoren.
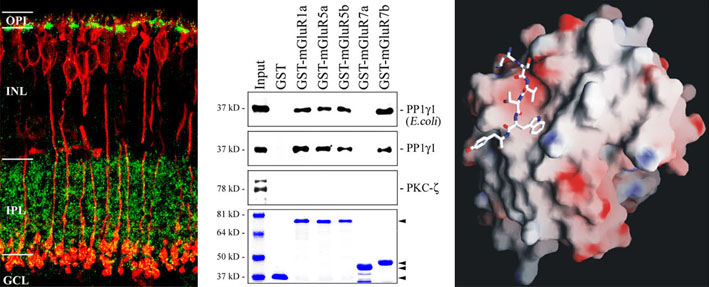
Die Abbildung zeigt ausgewählte Daten zur Interaktion der Proteinphosphatase 1 mit metabotropen Glutamatrezeptoren in Bipolarzellen der Netzhaut.
Als ein wichtiger Auslöser neurodegenerativer Prozesse wird eine erhöhte Konzentration des erregenden Neurotransmitters Glutamat diskutiert, ein Prozess, der als Exzitotoxizität bezeichnet wird. Bei chronischen Glaukomerkrankungen könnten durch diesen Mechanismus Ganglienzellen der Retina absterben, wodurch der Sehnerv degeneriert und die Patienten erblinden. Während ausführliche Studien über den Zusammenhang zwischen Ganglienzelltod und ionotropen Glutamatrezeptoren (vor allem des NMDA-Typs) vorliegen, ist die Rolle der metabotropen Glutamatrezeptoren in neurodegenerativen Erkrankungen wenig untersucht.
Daher analysieren wir die retinale Genexpression in einem Mausmodel für chronische Glaukome, bei dem der optische Nerv durch apoptotische Mechanismen retinaler Ganglienzellen degeneriert. Im Vergleich zu Kontrolltieren fanden wir eine signifikante Überexpression verschiedener metabotropen Glutamatrezeptoren und epithelialer Natriumkanäle (ENaC), während die Expression von GABAc Rezeptoren im Verlauf der Apoptose unverändert blieb. Durch den Einsatz von DNA-Chip Analysen und subtraktiven Hybridisierungstechniken identifizierten wir weitere Proteine, die in glaukomatösen Netzhäuten spezifisch reguliert sind, und daher am Absterben retinaler Ganglienzellen beteiligt sein könnten.

